Dentinski graft – sadašnjost ili budućnost
Ana Puhar¹, Janja Raštegorac¹
Doc. dr. sc. Marko Vuletić²
[1] Studentice pete godine, Stomatološki fakultet Sveučilišta u Zagrebu
[2] Zavod za oralnu kirurgiju, Stomatološki fakultet Sveučilišta u Zagrebu
SAŽETAK
Dentinski graft relativno je nov materijal u području regenerativne oralne kirurgije, a dobiva se preradom pacijentovih vlastitih zuba. Budući da dentin svojom strukturom i sastavom podsjeća na prirodnu kost, pokazuje dobra osteokonduktivna i osteoinduktivna svojstva, što ga čini pogodnim za poticanje obnove koštanog tkiva. Njegove glavne komponente, poput kolagena tipa I, hidroksiapatita te minerala poput kalcija i fosfata, pridonose stvaranju uvjeta pogodnih za djelovanje osteogenih stanica. Kako bi se dobio klinički siguranmaterijal, dentin se prije upotrebe pažljivo obrađuje. Zahvati poput augmentacije alveolarnog grebena, podizanja dna maksilarnog sinusa i prezervacije postekstrakcijske alveole pokazali su dobre rezultate prilikom korištenja dentinskog grafta. Osim što je biokompatibilan, njegova autologna priroda smanjuje mogućnost imunološke reakcije i širenja infekcije. Ipak, njegova primjena ovisi o dostupnosti prikladnih zuba za preradu. Također, biološka učinkovitost grafta može se poboljšati kombiniranjem s faktorima rasta ili matičnim stanicama. Zbog svega navedenog, dentinski graft predstavlja zanimljivu i vrijednu alternativu standardnim graft materijalima u suvremenoj dentaloj medicini.
KLJUČNE RIJEČI: dentinski graft; ekstrakcija zuba; augmentacija alveolarnog grebena; biokompatibilni materijali; osteoindukcija; oseointegracija; dentalni implantati
Uvod
Ekstrakcija zuba često je prvi korak koji pokreće niz promjena u usnoj šupljini, posebno na razini alveolarnog grebena. Iako proces cijeljenja nakon ekstrakcije vodi stvaranju novog tkiva, istovremeno dolazi i do gubitka kosti, što može otežati daljnje protetsko ili implantološko liječenje. Zbog toga su razvijene tehnike i materijali kojima se nastoji sačuvati što više alveolarne kosti. Noviji pristup u području regeneracije kosti jest primjena dentinskog grafta, biomaterijala koji se dobiva iz ekstrahiranih zuba pacijenata na kojima se i primjenjuje. Zahvaljujući svojem prirodnom sastavu i prisutnosti biološki aktivnih molekula, dentinski graft ima značajan potencijal u obnovi koštanog tkiva.
Cijeljenje kosti i resorpcija alveolarnog grebena nakon ekstrakcije zuba
Veliki broj zuba uklanja se godišnje zbog različitih uzroka kao što su teški oblici parodontitisa, impaktirani treći kutnjaci ili nerestorabilni zubni karijes. Nakon ekstrakcije zuba događa se biološki proces cijeljenja rane, kao i procesresorpcije alveolarne kosti [1]. Cijeljenje rane odvija se u tri faze: inflamatorna faza, proliferativna faza i faza modelacije i remodelacije. U prvim danima nakon ekstrakcije zuba dolazi do formiranja krvnog ugruška koji zaustavlja krvarenje iz oštećenih krvnih žila. Unutar narednih 2-3 dana upalne stanice naseljavaju ranu, a kombinacija upalnih stanica, nezrelih fibroblasta i novonastalih kapilara tvori granulacijsko tkivo [2]. Granulacijsko tkivo postupno se zamjenjuje vezivnim tkivom te započinje proliferativna faza cijeljenja rane, koja se događa dva tjedna nakon vađenja zuba, a karakterizira je prisutnost osteoprogenitornih stanica. Slijedi diferencijacija u osteoblaste koji proizvode nezrelu kost oko krvnih žila [3]. Treća faza cijeljenja, faza modelacije i remodelacije, odvija se u narednih nekoliko tjedana. Modelacija podrazumijeva promjenu oblika i arhitekture kosti, dok remodelacija predstavlja promjenu bez popratne promjene oblika i arhitekture kosti. Dakle, proces modelacije kosti podrazumijevaresorpciju zubne alveole zbog aktivnosti osteoklasta, dok se procesom remodelacije resorbirana nezrela kost mijenja sa zrelom kosti djelovanjem osteoblasta [2]. Tijekom prva tri mjeseca nakon ekstrakcije dolazi do ubrzanog gubitka kosti, a istraživanja pokazuju i do 50% smanjenja širine alveolarnog grebena u 12 mjeseci nakon ekstrakcije pri čemu je resorpcija izraženija s bukalne strane. Gubitak tkiva zbog remodeliranja nastavlja se i nakon toga, ali sporijom brzinom [1]. Bitno je napomenuti da je gubitak tkiva veći u horizontalnoj, nego u vertikalnoj dimenziji, dok kod višestrukih ekstrakcija nastaje značajan gubitak i u horizontalnoj i u vertikalnoj dimenziji [2].
Tehnike i materijali augmentacije
Značajne dimenzionalne promjene alveolarnog grebena mogu otežati buduće protetske i implantološke zahvate. U svrhu rekonstrukcije koštanih defekata koriste se različiti materijali za augmentaciju kosti. Augmentacija kosti podrazumijeva postupke kojima se ispravljaju koštani defekti nastali nakon ekstrakcijezuba ili uslijed drugih patoloških procesa. Ključne osobine koštanog nadomjesnog materijala su osteoinduktivnost, osteokonduktivnost i osteogeneza. Osteoinduktivnost označava sposobnost materijala da stimulira i aktivira nediferencirane stanice iz okolnog tkiva na diferencijaciju u osteoblaste koji stvaraju kost [4]. Osteokonduktivnost podrazumijeva svojstvo augmentacijskog materijala da služi kao potpora tj. nosač za osteoprogenitorne stanice čime omogućava rast nove kosti [5]. Osteogeneza se pojavljuje kada vitalni osteoblasti koji potječu iz koštanog transplantata doprinose rastu nove kosti zajedno s formiranjem kosti [6]. U kliničkoj praksi koriste se različiti materijali za augmentaciju od kojih se autologna kost, uzeta od samog pacijenta, tradicionalno smatra najboljom opcijom. Naime, ona prirodno sadrži sve tri ključne osobine koštanog nadomjesnog materijala. Ipak, upotreba autologne kosti nije bez rizika –potrebno je dodatno kirurško mjesto koje predstavlja još jedno potencijalno mjesto za postoperativnu bol i komplikacije [6]. Također, ograničena je i količina materijala dostupnog za transplantaciju [4]. Alogeni graftovi, koji potječu od ljudskih donora, imaju dobru osteoinduktivnost i osteokonduktivnost. Njihovom obradom, koja je potrebna kako bi se uklonila opasnost od širenja infekcije i odbacivanja transplantata, smanjuje se njihova biološka aktivnost i gube se stanice koje omogućuju osteogenezu [6]. Ksenogeni koštani nadomjesci, najčešće iz goveđe ili svinjske kosti, sastoje se od poroznih čestica hidroksiapatita dobivenih nakon kemijske obrade. Ovi graftovi djeluju isključivo osteokonduktivno [7]. Aloplastični graftovi izrađeni su od sintetičkih materijala poput bioaktivnog stakla i trikalcijevog fosfata. Oni također imaju samo svojstvo osteokondukcije, a ne sadrže aktivne biološke čimbenike potrebne za regeneraciju [6].Trenutno dostupni materijali za presađivanje, poput ksenogenih (npr. goveđeg podrijetla) i sintetskih aloplastičnih materijala, imaju određena ograničenja kada je riječ o poticanju regeneracije i očuvanju volumena alveolarnog grebena. Primjerice, ksenogeni graftovi zbog svoje visoke razine kristalizacije i niske biorazgradivosti ostaju dugo prisutni na mjestu defekta, što može usporiti prirodno remodeliranje kosti i ometati revaskularizaciju tkiva [7]. Aloplastični materijali, iako su biokompatibilni, nemaju biološki aktivne komponente koje bi potaknule diferencijaciju stanica i stvaranje nove kosti [6]. Nadalje, mogućnost nastanka infekcije, ograničena količina materijala i visoka cijena potiču da se sve više istražuju alternative tradicionalnim materijalima. U novije vrijeme, istraživanja naglašavaju prednosti korištenja dentinskog grafta kao materijala za augmentaciju kosti. Dentinski graft je autologan čime se eliminira rizik od imunoloških reakcija i prijenosa infekcije te njegova biološka aktivnost može potaknuti bržu remodelaciju i bolje očuvanje alveolarnog grebena [8]. Navedene prednosti čine dentinski graft zanimljivim biomaterijalom za primjenu u augmentacijskim postupcima u dentalnoj medicini.
Dentinski graft
Dentin čini većinu tvrdog zubnog tkivate pridonosi boji i elastičnosti cakline, dok svojom podražljivošću štiti pulpu od djelovanja vanjskih podražaja. Uz zube, kosti čeljusti i alveolarne kosti razvijaju se iz stanica neuralnog grebena, zbog čega kost i dentin imaju iste makromolekularne strukture u vrlo sličnim omjerima [9].Sastoji se od anorganske tvari (70 % dentin, 65 % kost) u obliku kalcijevog fosfata –hidroksiapatita, te organske tvari (20 % dentin, 25 % kost) koju čine kolagena mreža tipa I (90 %) i nekolageni proteini (10 %) poput osteokalcina, osteopontina, dentinskog fosfoproteina te brojnih čimbenika rasta [9, 10]. Važno svojstvo hidroksiapatita u strukturi dentina je nizak stupanj kristalizacije te mogućnost njegove potpune resorpcije i zamjene novostvorenom kosti [10, 11]. Demineralizirani dentinski matriks pokazuje znatno veća osteoinduktivna svojstva zbog veće eksponiranosti kolagenih vlakana koja su važna za vezanje osteoblasta na površinu grafta [10, 11]. Dentinski graft, zbog svog sastava, ima izražen osteoinduktivni i osteokonduktivni potencijal [11, 12]. Osteoinduktivni potencijal kao sposobnost stvaranja kosti očituje se prisutnošću kolagena tipa I i molekula kao što su koštani morfogenetski protein (BMP), IGF-II i IGF-β [9, 10]. BMP potiče diferencijaciju osteoprogenitornih stanica u osteoblaste i njihovu proliferaciju, čime dolazi do nastanka osteoidne matrice. Kolagen koji se nalazi u dentinu omogućava osteoblastima sidrenje u brojne dentinske tubuluse. Osim osteoblasta, potiče i migraciju stanica krvnih žila koje urastaju u tubuluse, omogućujući tako potpunu integraciju dentinskog grafta i njegovu postupnu resorpciju te zamjenu koštanim tkivom. Na prirast stanica utječu i čimbenici rasta, čije je oslobađanje povezano s veličinom pora dentina [10]. Optimalna veličina čestica koje se međusobno povezuju i potiču stvaranje kosti je između 250 μm i 1000 μm. Najbolji rezultati u regeneraciji kosti postignuti su česticama veličine oko 1000 μm, jer tada brzina resorpcije i odlaganja nove kosti ostaje uravnotežena [11, 13].Histološkim analizama vidljivo je da se u početku dentinske čestice obavijaju vezivnim tkivom, potom dolazi do stvaranja nezrele kosti, a naposljetku do formiranja zrele kosti s integriranim dentinskim česticama kojih je manje nego na početku zbog postupne resorpcije [12, 13].
Priprema dentinskog grafta
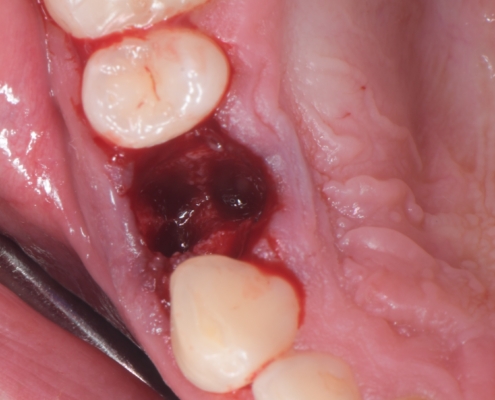
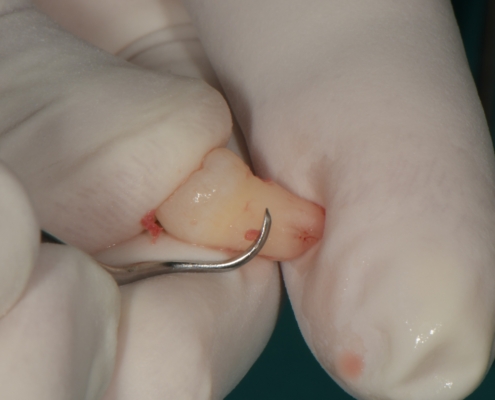
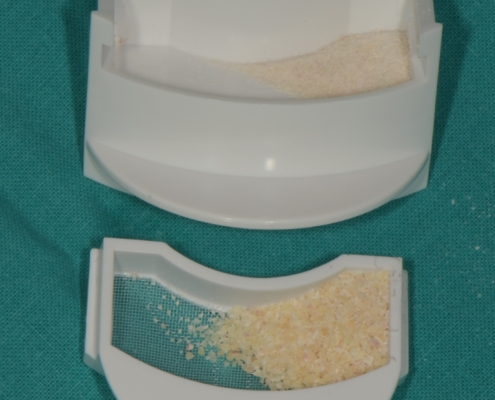
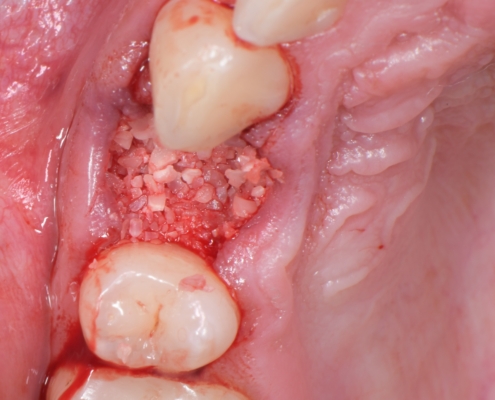
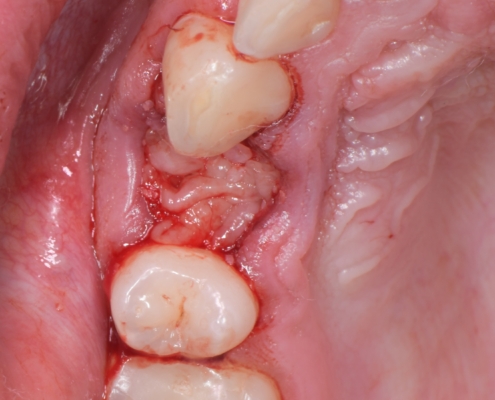
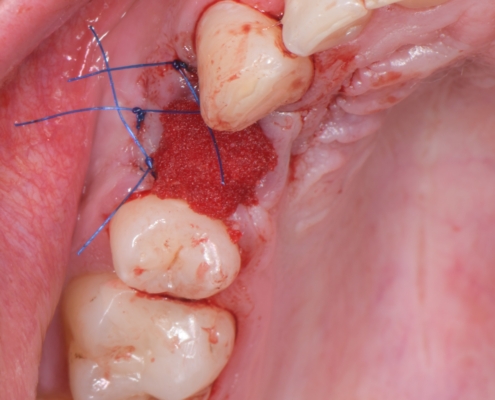
Priprema dentinskog grafta nakon ekstrakcije zuba traje 15–20 minuta., Ekstrakcijska alveola se kohleom očisti od mekih tkiva (Slika 1.). Postupak pripreme dentinskog grafta uključuje temeljito mehaničko čišćenje krune zuba od cakline, ispuna, pigmentacija, karijesa, cementa i protetskih nadomjestaka te korijena zuba od mekih tkiva (Slika 2.). Zub se potom suši pusterom i stavlja u sterilnu jednokratnu komoru uređaja Smart Dentin Grinder (KometaBio inc., Cresskill, NJ, SAD), koji ga usitnjava u čestice veličine između od 300 μm do 1200 μm (Slika 3.) te se potom odvajaju kroz sito uređaja s obzirom na veličinu u za to predviđene pretince (Slika 4.). Usitnjene čestice se zatim kemijski obrađuju otopinom natrijevog hidroksida i alkohola kroz 5 minuta, a nakon toga se dvaput ispiru fiziološkom otopinom puferiranom fosfatima, čime se postiže fiziološki pH od 7,2 (Slika 5.). Preostali vlažni dentinski graft tada je spreman za primjenu u augmentaciji (Slika 6.). Alternativno, usitnjeni dentinski prah može se sterilizirati zagrijavanjem na temperaturu od 140 °C radi potpune eliminacije bakterija, virusa i endotoksina [14]. Usitnjeni veći dijelovi zuba se postavljaju u defekt alveole (Slika 7.), radi bolje regeneracije postavlja se PRGF membrana (Slika 8.) te se završno može postaviti kolagenska spužva za potpunu adaptaciju grafta (Slika 9.). Završno slijedi postava šavova i standardna postoperativna njega.
Indikacije
Cijeljenje alveolarnog grebena nakon ekstrakcije zuba uključuje resorpciju kosti, što može dovesti do estetskih i funkcionalnih poteškoća te ograničenih mogućnosti budućih implantoprotetskih rješenja. Neizbježna resorpcija kod koštanog tkiva dovodi do horizontalnog dimenzijskog smanjenja koje iznosi 3,79 ± 0,23 mm te je veće od vertikalnog smanjenja koje iznosi 1,24 ± 0,11 mm na bukalnoj, 0,84 ± 0,62 mm na mezijalnoj i 0,80 ± 0,71 mm na distalnim mjestima nakon 6 mjeseci. Postotak vertikalne dimenzijske promjene je 11-22% nakon 6 mjeseci, dok horizontalne iznosi 32% nakon 3 mjeseca i 29-63% nakon 6-7 mjeseci. Općenito, promjene su izraženije s bukalne strane u odnosu na lingvalnu stranu alveolarnog grebena [15].Dentinskim graftom se možemo poslužiti u prezervaciji postekstrakcijske alveole, podizanju dna maksilarnog sinusa, augmentaciji alveolarnog grebena te boljoj osteointegraciji dentalnih implantata. Postupak prezervacije alveole uključuje punjenje postekstrakcijske alveole materijalom za očuvanje kontura alveolarnog grebena i mekih tkiva [11,12]. Pregledni rad Fenga i sur. [16]. 2023. pokazao je kliničku i histomorfološku učinkovitost dentinskog grafta u usporedbi s cijeljenjem krvnim ugruškom i drugim materijalom. Rezultati od 10 uključenih istraživanja s 182 ispitanika pokazali su da je dentinski graft učinkovitije održao horizontalnu i vertikalnu dimenziju ekstrakcijskih alveola u usporedbi sa spontanim cijeljenjem te bolju regeneraciju kosti i učinkovitiju razgradnju od drugih materijala za augmentaciju. Vrlo često je razina kostiju u stražnjem maksilarnom području zbog pneumatizacije sinusa nedovoljna. U tim slučajevima se preporučuje podizanje dna maksilarnog sinusa (sinus lift) uz pomoć dentinskog grafta pomiješanog s ksenogenom kosti što je omogućilo ugradnju implantata bez komplikacija poput periimplantatnog mukozitisa ili periimplantitisa [11]. Istraživanje Kima i suradnika [17]. 2014. uspoređuje resorpciju kosti oko implantata između autogenog dentinskog grafta i sintetičkog koštanog nadomjeska nakon sinus lifta. U tom istraživanju je sudjelovalo 37 osoba podijeljenih u dvije skupine. U skupini I kod17 osoba postavljen je autogeni dentinski graft dok je u skupini II. s 20 osoba postavljena sintetska (aloplastična) kost s naknadnim postavama implantata kod svih ispitanika. Debljina kosti praćena je ortopantomogram prije i nakon postave umjetne kosti iimplantata te godinu dana nakon te je praćena resorpcija kosti oko implantata. Visina kosti povećana je 4,89mm kod prve skupine te 6,22 u drugoj skupini, dok je prosječna resorpcija u prvoj bila 0,76mm, odnosno 0,53mm. Međutim, prosječna razlika povećanjakosti i resorpcije nije pokazala značajnu statističku razliku, prema tome se dentinski graft može smatrati dobrom alternativom sintetskim koštanim nadomjestkom [17].Kim i suradnici 2014. [18] su također radili i na istraživanju regeneracije periimplantatnog koštanog defekta postupkom vođene koštane regeneracije (GBR) i postave djelomično demineraliziranog dentinskog grafta uz naknadnu postavu implantata. Istraživanje je provedeno na 15 slučajeva kod kojih su nakon 2 i 4 mjeseca od postupka uzeti histološki uzorci. Nakon 2 mjeseca uzorci tkiva pokazali su prisutnost upalnih stanica, znakove krvarenja te nalaze izravnu infiltraciju s novonastalom kosti, a rahlo vezivno tkivo i kost prodrli su na resorbiranom mjesto transplantata. Dobro vaskularizirana rastresita vlaknasta tkiva okruživala se novostvorenu kost. Kod uzoraka uzetih nakon 4 mjeseca, materijal nadomjestka bio je izravno spojen s novonastalom kosti. Novonastala kost infiltrirala se u resorbirano mjesto materijala transplantata. Ispitanici su praćeni kroz idućih 31 mjesec te je uočena stabilna razina krestalne kosti uz implantate [18].Osim postave usitnjenog dentinskog grafta, Schwarz i suradnici [19]. 2018. ispituju mogućnost upotrebe dentinskih blokova za augmentaciju alveolarnog grebena te uspješnost osteointergacije implantata. Istraživanje je provedeno na 30 ispitanika kojima je bila potrebna implantološka terapija i horizontalna augmentacija grebena. Ispitanici su podijeljeni u dvije skupine gdje je u jednoj skupini postavljen posebno oblikovan zdravi autogeni korijen zuba, a u drugu autogeni koštani blokovi uzeti iz retromolarnog područja. Nakon 26 tjedana postavljeni su implantati. Kod svih ispitanika debljina grebena je bila adekvatna te je osteointegracija implantata bila uspješna kod oba grafta [19]. Augmentacija alveolarnog grebena pomoću blokova dentinskog grafta ili usitnjenog grafta pokazuje zadovoljavajuće rezultate u održavanju volumena kosti i osteointegraciji implantata [12].
Zaključak
Autologni dentinski graft se pokazao kao vrlo dobar biološki nadomjesni materijal za regeneraciju kosti. Njegova biološka kompatibilnost, visoki osteoinduktivni i osteokonduktivni potencijal, omogućuje primjenu u očuvanju dimenzija alveole, sinus liftu te augmentaciji alveolarnog grebena. Zbog svoje visoke molekularne sličnosti s građom kosti, ostvaruje izvrsne rezultate u održavanju vertikalne i horizontalne dimenzije te povoljnu osteointegraciju implantata. Autologna priroda čini ga vrlo lako dostupnom, brzom i biološki prihvatljivom opcijom te smanjuje rizike od komplikacija na minimum i ubrzava regeneraciju. Buduća istraživanja trebala bi dodatno potvrditi dugoročne kliničke prednosti dentinskog grafta za brojne kliničke indikacije u usporedbi sa standardnim augmentacijskim materijalima.
Literatura
1. Miron RJ, Zhang Y, editors. Next-generation biomaterials for bone & periodontal regeneration. 1st ed Batavia, IL: Quintessence Publishing Co, Inc; 2019. 384-9.
2. Araújo MG, Silva CO, Misawa M, Sukekava F. Alveolar socket healing: what can wenlearn? Periodontol 2000. 2015 ;68(1):122–34.
3. Bahney CS, Zondervan RL, Allison P, Theologis A, Ashely JW, Ahn J, et al. Cellular biology of fracture healing. J Orthop Res. 2019 ;37(1):35–50.
4. Giannoudis PV, Dinopoulus H, Tsiridis E. Bone supstitutes: an update. Injury. 2005;36(Suppl 3):S20–7.
5. Albrektsson T, Johansson C. Osteoinduction, osteoconduction and osseointegration. Eur Spine J. 2001;10(Suppl 2):S96–101.
6. Kumar P, Vinitha B, Fathima G. Bone grafts in dentistry. J Pharm Bioallied Sci. 2013;5(Suppl 1):S125–7.
7. Zhao R, Yang R, Cooper PR, Khurshid Z, Shavandi A, Ratnayake J. Bone Grafts and Substitutes in Dentistry: A Review of Current Trends and Developments. Molecules. 2021 ;26(10):3007.
8. Zhang S, Li X, Qi Y, Ma X, Qiao S, Cai H, Zhao BC, Jiang HB, Lee ES. Comparison of Autogenous Tooth Materials and Other Bone Grafts. Tissue Eng Regen Med. 2021;18(3):327-41.
9. Goldberg M, Kulkarni AB, Young M, Boskey A. Dentin: structure, composition and mineralization. Front Biosci (Elite Ed). 2011;3:711-35.
10. Murata M. Collagen biology for bone regenerative surgery. J Korean Acad Periodontol. 2003;33(6):395-404.
11. Miron RJ, Zhang Y. Next-generation biomaterials for bone & periodontal regeneration. Dent Mater J.2017;36(1):1-15.
12. Sánchez-Labrador L, López-González JD, Torres-Lagares D, et al. Autogenous dentin graft after third molar extraction for socket preservation: histological study and clinical outcomes. J Clin Exp Dent. 2020;12(11):e1065-e70.
13. Calvo-Guirado JL, Maté-Sánchez de Val JE, Gómez-Moreno G, et al. Use of particulate autogenous dentin grafts for socket preservation: a retrospective clinical study. Med Oral Patol Oral Cir Bucal. 2018;23(4):e467-e74.
14. Binderman I, Hallel G, Yaffe A, et al. A novel procedure to process extracted teeth for immediate grafting of autogenous dentin. J Interdiscip Med Dent Sci. 2014;2(3):1-5.
15. Tan WL, Wong TL, Wong MC, Lang NP. A systematic review of post-extractional alveolar hard and soft tissue dimensional changes in humans.Clin Oral Implants Res. 2012 Feb;23 Suppl 5:1-21.
16. Feng Y, Zhao R, Li J, Yuan Z, Xu X, Gong J. Efficacy of autogenous particulated dentin graft for alveolar ridge preservation: a systematic review and meta-analysis of randomized controlled trials. Medicine(Baltimore). 2023;102(48):e36112.
17. Kim YK, Lee J, Yun JY, Yun PY, Um IW. Comparison of autogenous tooth bone graft and synthetic bone graft materials for bone resorption around implants after sinus lift using a crestal approach: a retrospective study. J Periodontal Implant Sci. 2014;44(5):216-21.
18. Kim YK, Kim SG, Bae JH, Um IW, Oh JS, Jeong KI. Guided bone regeneration using autogenous tooth bone graft in implant therapy: case series. Implant Dent. 2014;23(2):138-43.
19. Schwarz F, Hazar D, Becker K, Sader R, Becker J. Efficacy of autogenous tooth roots for lateral alveolar ridge augmentation and staged implant placement. A prospective controlled clinical study. J Clin Periodontol. 2018 Aug;45(8):996-1004.